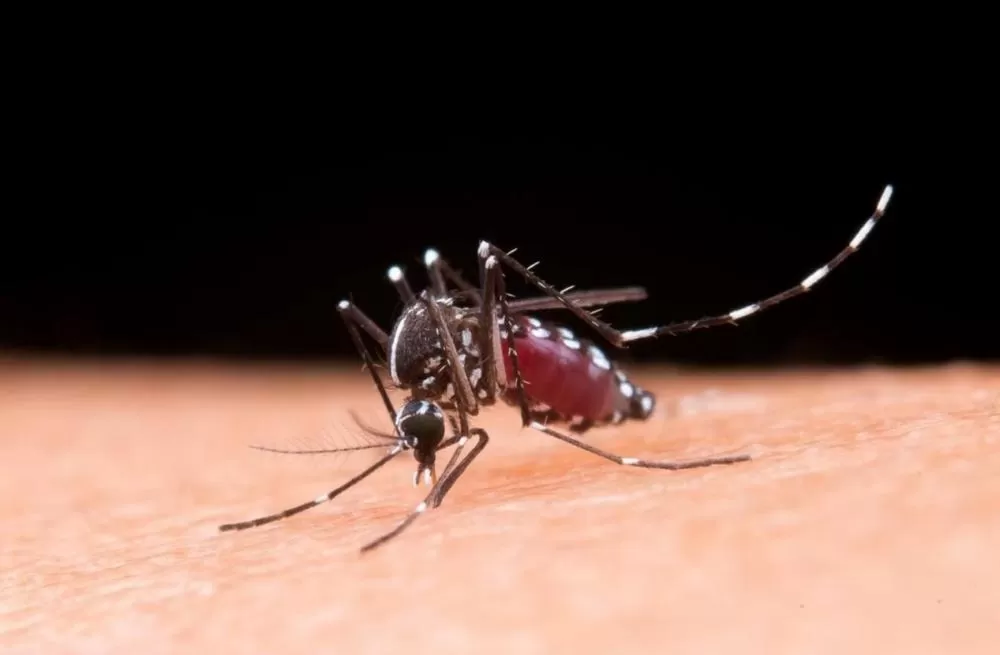
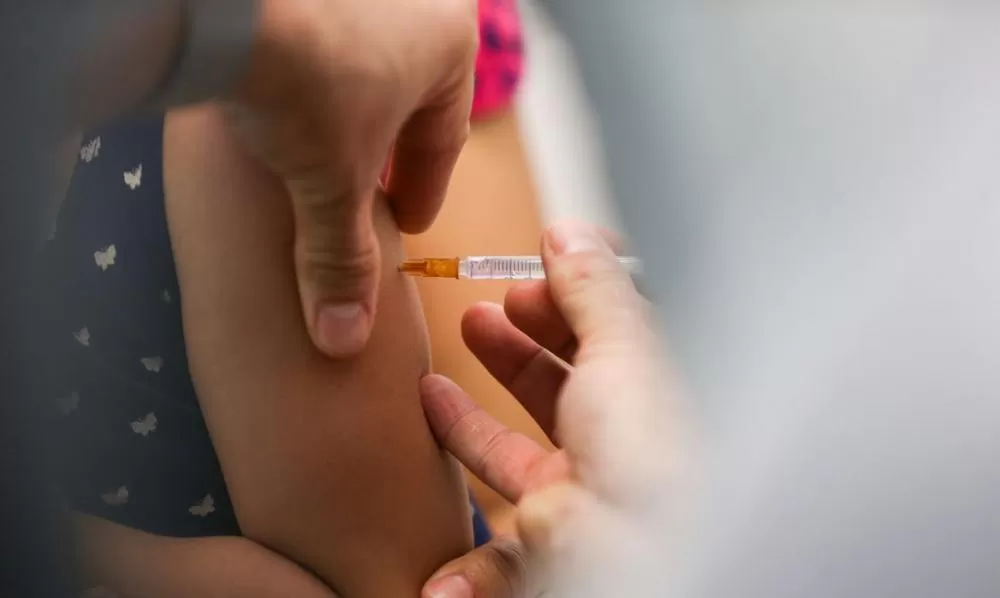
A Agência Nacional de Vigilância Sanitária (Anvisa) aprovou nesta segunda-feira, 14 de abril, o registro da vacina IXCHIQ, desenvolvida pelo Instituto Butantan para prevenção da chikungunya. Esta é a primeira vacina aprovada no Brasil especificamente para combater o vírus transmitido pela picada do mosquito Aedes aegypti, o mesmo responsável pela transmissão da dengue. A imunização será feita em dose única e será indicada para pessoas com 18 anos ou mais que estejam sob risco aumentado de exposição ao vírus.
Segundo a Anvisa, a vacina demonstrou eficácia ao induzir uma resposta robusta de anticorpos neutralizantes contra o vírus da chikungunya em estudos clínicos realizados com adultos e adolescentes no Brasil e nos Estados Unidos. O imunizante é contraindicado para mulheres grávidas, pessoas imunodeficientes ou imunossuprimidas. A decisão da Anvisa também levou em consideração avaliações feitas em parceria com outras autoridades internacionais, como a FDA, dos Estados Unidos, e a Agência Europeia de Medicamentos (EMA), que já haviam aprovado o imunizante para uso em seus respectivos países.
A vacina IXCHIQ é uma vacina recombinante atenuada, desenvolvida originalmente pela farmacêutica austríaca Valneva, e será inicialmente fabricada na Alemanha pela IDT Biologika GmbH. O Instituto Butantan prevê iniciar a produção nacional no futuro. Para viabilizar o registro no Brasil, a Anvisa e o Butantan firmaram um Termo de Compromisso que prevê a realização de estudos adicionais de efetividade e segurança, além da implementação de ações de farmacovigilância ativa para monitoramento contínuo do perfil da vacina.
A chikungunya é uma arbovirose que chegou ao continente americano em 2013 e foi confirmada no Brasil em 2014, com os primeiros casos detectados no Amapá e na Bahia. Desde então, o vírus se espalhou por todos os estados brasileiros. A doença causa febre alta, dores intensas nas articulações e pode levar a complicações graves, especialmente em populações mais vulneráveis.
A análise da vacina pela Anvisa envolveu uma equipe técnica especializada, que avaliou dados de produção, qualidade e os resultados dos ensaios clínicos. O processo também contou com a participação da agência no projeto OPEN, da EMA, que permite a cooperação internacional entre autoridades regulatórias em avaliações de medicamentos e vacinas de interesse público. Além disso, o imunizante foi analisado pelo Grupo de Trabalho da Câmara Técnica de Medicamentos, formado por especialistas em arboviroses e desenvolvimento vacinal.


Mín. 19° Máx. 26°