Um estudo conduzido por pesquisadores da Universidade Federal do Rio de Janeiro (UFRJ) trouxe esperança a pacientes com lesões graves na medula espinhal. O grupo desenvolveu, em parceria com o laboratório farmacêutico brasileiro Cristália, um medicamento experimental derivado da placenta humana, batizado de Polaminina. Embora ainda não autorizado para uso clínico e sem validação da Agência Nacional de Vigilância Sanitária (Anvisa), os primeiros resultados apontam para a possibilidade de recuperação de movimentos em pessoas com diagnóstico de paraplegia ou tetraplegia.
O princípio ativo do fármaco é a laminina, molécula estudada há décadas pela professora Tatiana Coelho de Sampaio. Presente em organismos primitivos, ela é responsável por funções essenciais de regeneração celular. A pesquisa mostrou que a substância pode contribuir tanto para a proteção de neurônios quanto para o estímulo à regeneração, abrindo caminho para novos tratamentos.
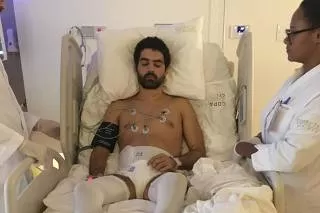
Desde 2018, seis pacientes com lesões completas foram submetidos ao medicamento, aplicado diretamente na medula espinhal em até seis dias após o trauma. Cinco deles apresentaram evolução significativa, passando do nível A, em que não há movimento nem sensibilidade, para o nível C, que permite alguma recuperação motora. Um dos casos mais emblemáticos foi o do jovem Bruno Drummond, que havia perdido totalmente os movimentos após um acidente de trânsito. Com o tratamento precoce e fisioterapia intensiva, ele conseguiu retomar a mobilidade e hoje voltou a caminhar.
Os pesquisadores ressaltam, no entanto, que ainda não existem respostas definitivas sobre a dosagem ideal, o tempo de duração dos efeitos ou a eficácia em lesões crônicas. Em alguns casos, como o da atleta Hawanna Cruz, que sofreu lesão medular três anos antes de iniciar o tratamento, houve ganhos importantes, embora menos abrangentes.
O entusiasmo com os resultados não elimina a necessidade de etapas regulatórias. A Anvisa informou que ainda não recebeu solicitação formal para a fase 1 dos testes clínicos, que visa avaliar a segurança da substância em um grupo reduzido de voluntários. Atualmente, a agência analisa informações complementares enviadas pela farmacêutica e reforça que, até o momento, não há evidências suficientes para atestar segurança e eficácia em larga escala.
Caso receba autorização, a fase inicial de testes deve incluir um número maior de participantes e avançar para etapas subsequentes, com estudos comparativos e acompanhamento mais amplo. A expectativa dos pesquisadores é que o processo até a eventual liberação do medicamento possa levar pelo menos três anos. Hospitais como o das Clínicas e a Santa Casa de São Paulo já manifestaram interesse em participar dos estudos, caso sejam aprovados.



Mín. 18° Máx. 22°